A kezelés szellemi atyja, Ronald Levy szerint az egyelőre csak egerekben kipróbált eljárás elvben bármilyen daganattípus kezelésére alkalmas lehet, és a klinikai próbák már 2018 vége felé megkezdődhetnek. Tátrai Péter biológus közérthető írásában részletesen elemzi az év elején bejelentett, nagy szakmai és sajtóvisszhangot keltett eredményt.
A cikk a Magyar Tudományos Akadémia honlapján jelent meg.
„Áttörést hozhat a rák gyógyításában” – annyiszor olvastuk-hallottuk már ezt a frázist, hogy nehéz hiteles szavakat találni, amikor
úgy tűnik, valóban áttörés körvonalazódik a daganatok kezelésében.
Márpedig ha a Stanford Egyetem kutatóinak 2018. január 31-én a Science Translational Medicine-ben közölt egérkísérletes eredményei emberben is megismételhetőek lesznek – és az előzetes jelek biztatóak erre nézve –, az túlzás nélkül új fejezetet nyithat az onkológiában.
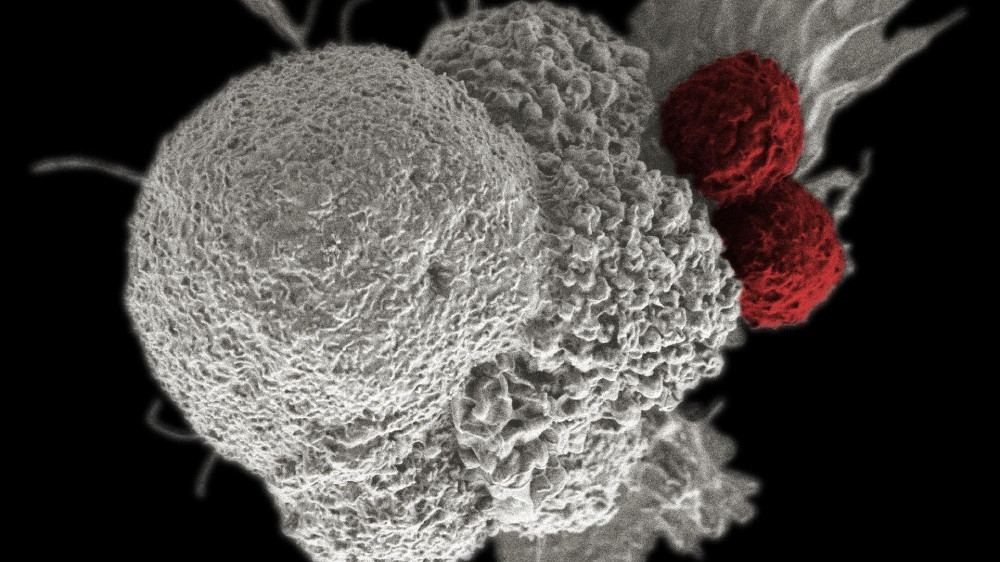
A Ronald Levy laboratóriumában kidolgozott immunterápiás eljárás során két immunstimuláns parányi mennyiségét közvetlenül a daganatba fecskendezték, amivel aktivizálták a daganatba beférkőzött, de ott támadásképtelen állapotba került immunsejteket. Az aktivizálás nyomán kialakuló immunválasz nemcsak a megcélzott daganatot pusztította el, de a szervezet bármely más pontján található azonos típusú daganatokat is, sőt, megakadályozta vagy lefékezte az ugyanilyen daganatok későbbi kialakulását.
Egy olyan eljárás, amely maradéktalanul elpusztítja az elsődleges daganatot és annak áttéteit egyaránt, és még a tumor kiújulásának is elejét veszi,
elérhető közelségbe hozza azt a mindig is áhított célt, hogy a rákra elkerülhetetlen végzet helyett kordában tartható krónikus betegségként gondolhassunk.
Ráadásul – ellentétben még a modern célzott daganatterápiás szerekkel is, amelyek egy meghatározott molekuláris célpont támadásával legfeljebb a daganatok körülírt csoportjait támadhatják – az immunterápiának ez a formája elvben bármilyen daganattal szemben alkalmazható. „Nem hiszem, hogy bármi is behatárolná a módszerünkkel potenciálisan kezelhető tumortípusok körét, feltéve, hogy az immunrendszer sejtjei be tudnak hatolni a daganatba” – nyilatkozta a cikk kapcsán a tumor-immunterápia apostolaként számon tartott Levy, aki az 1980-as évek óta megkerülhetetlen alakja e kutatási területnek, és kulcsszerepet játszott az egyik első törzskönyvezett rákellenes ellenanyag, a rituximab koncepciójának kidolgozásában.
Az immuno-onkológia úttörője: William Coley
Az a gondolat, hogy az immunrendszert a daganatok ellen lehetne fordítani, nem újkeletű: William Bradley Coley amerikai sebész 1891-ben publikálta híres kísérletsorozatának eredményeit, melyben rákbetegekbe eleinte élő, utóbb elölt baktériumokat fecskendezett, azt remélve, hogy az így felszított immunválasz mintegy oldalcsapásként a daganatot is elpusztítja majd. Elméletét azokra a korábbi sporadikus, ám hitelesen dokumentált esetekre alapozta, melyekben magas lázzal járó orbánc-fertőzésen átesett rákbetegek váratlan módon felgyógyultak daganatukból. Először saját kórházának archívumában kutakodva akadt egy ilyen esettanulmányra, majd ezen fellelkesülve tovább keresett, és egyebek között más orvos-úttörők – így Robert Koch, Louis Pasteur és Emil von Behring – feljegyzéseiben is talált példákat a Streptococcus pyogenes baktérium okozta orbánc és a spontán daganatfelszívódás kapcsolatára. Bár Coley történelmi esetekre nem hivatkozott, a daganatok fertőzéssel való kezelése valójában az ókori Egyiptomtól a középkoron át a 18-19. századi orvoslásig bevett gyakorlat volt, s például konkrétan az orbánc és a rákgyógyulás összefüggését – gyakorló orvosi minőségében – maga Anton Csehov is megemlítette.
Noha Coley néhány betegével látványos sikereket ért el, eredményeit nehéz volt értelmezni és reprodukálni. A baktériumkészítmény beadásával járó többletkockázat, s nem utolsó sorban a lehetséges hatásmechanizmus ismeretének teljes hiánya végül eltántorította korának orvosait a „Coley-toxinok” általános alkalmazásától, így a műtéti kimetszés és az ekkortájt tért hódító röntgen-besugárzás kombinációja került a korai 20. század onkológiai praxisának fősodrába.
Az immunőrjárat-elmélet és a modern immunterápia hajnala
Coley közleményétől számítva pontosan száz évet, 1991-ig kellett várni az első immun-onkoterápiás eljárás, az interleukin-2-kezelés gyógyszerhatósági elfogadásáig; ennyi ideig tartott, míg sikerült az immunrendszer és a rák kapcsolatának alapjait tisztázni, és az immunválasz erejét ellenőrzött módon szembefordítani a daganatokkal. Több évtizedes viszonylagos feledés után a modern onkoimmunológia korszakát az immunőrjárat (immunosurveillance) Lewis Thomas és Frank Macfarlane Burnet nevéhez köthető elmélete nyitotta meg 1957-ben. Az elmélet szerint a daganatos elfajulás jóval közönségesebb esemény, mint ahogy a ténylegesen kifejlődő daganatok gyakoriságából vélhetnénk: szervezetünkben szinte folyamatosan keletkeznek potenciálisan rákos sejtek, ám ezeket a kezdeményeket
az immunrendszer testidegenként ismeri fel és elpusztítja, ezzel csírájában elfojtva a kóros sejtburjánzást.
„Egyáltalán nem elképzelhetetlen, hogy tumorsejtek apró csoportosulásai alakuljanak ki, amelyek új antigén-sajátosságokkal bíróként hatékony immunválaszt váltanak ki, és eltűnnek anélkül, hogy létezésükről klinikai jelt adtak volna” – fogalmazott 1970-es összefoglaló könyvében Burnet.
A koncepció hátterében Burnetnek az a felismerése állt, hogy az emberi immunrendszer nemcsak az idegent – értsd: más fajokból, vagy fajunk másik egyedeiből származó molekuláris struktúrákat –, de a megváltozott sajátot is antigénként, vagyis immunválasz által elpusztítandóként ismeri fel. Burnet megsejtette – bár kísérletesen még nem tudta bizonyítani –, hogy az immunrendszer az embrionális fejlődés során tanulja meg felismerni a saját struktúrákat, s amivel e kritikus periódus alatt nem találkozott, azt a későbbiekben nem-sajátnak, tehát antigénnek tekinti. Az ausztrál kutató, akit az „immunológiai saját” lényegének megragadásáért 1960-ban orvosi Nobel-díjjal tüntettek ki, szintén zseniálisan érzett rá arra, hogy a rákos sejtek immunológiai identitása megváltozik, holott ennek molekuláris biológiai okairól még nem lehettek ismeretei.
A tumorellenes immunitás szereplői
Azóta jól tudjuk, hogy
a daganatos elfajulás kiváltó oka a sejtek szintjén az örökítőanyag hol pontszerű, hol kiterjedt átrendeződésekkel járó megváltozása – mutációja –, s e mutációk rendszerint megváltozott szerkezetű fehérjéket eredményeznek.
Azt is tudjuk már, hogy magvas sejtjeinkben működik egy olyan mechanizmus, melynek révén a sejtek folyamatosan „kiteszik a kirakatba” a bennük képződő fehérjék összetördelt mintáit, s ezzel mintegy tájékoztatják a környezetüket fehérjekészletük állapotáról. Ha egy sejtbe vírus férkőzik, amely a sejtet saját fejérjéinek termelésére kényszeríti, e vírusfehérjék töredékei óhatatlanul kikerülnek a sejtfelszín I-es típusú MHC fehérjének (röviden MHCI-nek) nevezett hirdetőtábláira, s árulkodó jelként bélyegzik meg a sejtet az immunrendszer számára. Hasonlóképp, ha egy sejt DNS-e mutációkat szenved, s ezzel a sejt a rákos elfajulás útjára lép, tervét nem tarthatja egészen titokban, mert a „megváltozott saját” fehérjék töredékei a felszínre kihelyeződve hűen tudósítják az immunrendszert a benti történésekről. Azt a vírusfertőzött vagy rákos sejtet pedig, amely az MHCI és a rajta bemutatott fehérjetöredékek visszatartásával leplezné a benne zajló turpisságot – és ezzel a trükkel mind a vírusfertőzött, mind a rákos sejtek meg szoktak próbálkozni –, épp feltűnő némasága fogja gyanússá tenni és elárulni az immunrendszernek.
(...)
Hallatlan siker, mesés eredmény!
A módszer hallatlan sikerén felbátorodva – hiszen ne feledjük, hogy
négy vizsgált daganattípusból egyben 100 százalékos, kettőben 90 százalékos gyógyulási arány az onkológia mércéje szerint mesés eredménynek számít
– a Stanford kutatói még nagyobb fába vágták fejszéjüket: második kísérleti elrendezésükben emlőrákra veleszületetten hajlamos egereket próbáltak meg kezelni. E génmódosított egerekben már 6-7 hetes korra kialakul az első tapintható emlőtumor, és végül mind a tíz emlőjükben (az egereknek ugyanis ennyi van) daganatok fejlődnek, amelyek ráadásul nagy számú tüdőáttétet is adnak. Ebben a betegségmodellben az immunterápiától – vagy bármilyen más kezeléstől – teljes gyógyulást remélni irreális vágy lett volna; a tapasztalt hatás még így is minden várakozást felülmúlt. A kontrollcsoport egereivel a kísérlet kezdetétől – az első tapintható tumor megjelenésétől – számított 15 héten belül végzett a betegség, és ha a 80. napnál megvizsgálták tüdejüket, abban számos áttétet találtak. Az immunkoktéllal kezelt egerek csaknem háromnegyede ugyanakkor még a kísérlet 25. hetében is életben volt, és a kezelés a tüdőáttétek kialakulását is szinte teljesen megfékezte: többségükben a 80. napon egyáltalán nem észleltek tüdőmetasztázist. Fontos kiemelni, hogy a kutatók ebben az esetben is csak egyetlen daganatba – az elsőként kialakulóba – juttatták be az immunkoktélt, tehát a kezelés csak úgy gyakorolhatott hatást a többi emlő távoli daganataira és a tüdőáttétekre, ha az immunstimuláció nyomán az egész testre kiterjedő, tartós és daganatspecifikus immunválasz épült ki.
A mágikus koktél
Ezek után nyilván mindenkiben felmerül a kérdés: vajon miből állhat az a kétkomponensű varázskeverék, amely ilyen drámaian megfordítja a tumor és az immunrendszer közötti erőviszonyokat? Nos, a koktél semmilyen misztikus összetevőt nem tartalmaz. Egyik hatóanyaga egy DNS-töredék, az ún. CpG-oligonukleotid, a másik pedig a T-sejtek egyik sejtfelszíni stimuláló fehérjéjét, az OX40-et célzó ellenanyag. A hatásmechanizmusra vonatkozóan a szerzők kísérletekkel alaposan alátámasztott hipotézist állítottak fel, amit az alábbiakban vázolunk.
A CpG-oligonukleotid régóta jól ismert immunstimuláns, működését részletesen jellemezték. A baktériumoktól az emberig minden élőlény DNS-ében akadnak olyan régiók, amelyek egymást követő C és G nukleotidpárosokban, más szóval CpG-motívumokban gazdagok (a „CpG” rövidítésben a „p” a C-t és a G-t összekötő foszfodiészter-kötést szimbolizálja). Az emlősökben e CpG-gazdag régiók citozinjainak többsége egy hozzákapcsolt metilcsoportot visel, mivel a citozin-metilálásként ismert DNS-módosítás nálunk a génkifejeződés szabályozásának egyik alapvető eszköze. A prokarioták, köztük a kórokozó baktériumok DNS-ében viszont a CpG-gazdag régiók lényegében „pucérok”, bennük a citozinok jobbára metilálatlanul mutogatják magukat. Ezért egy metilálatlan citozinokat tartalmazó CpG-gazdag oligonukleotid – ami például egy falósejt által elpusztított és félig megemésztett baktériumból bőségesen felszabadul – vörös posztó az emlős immunrendszer számára: a metilálatlan CpG egyike azoknak a „patogén-asszociált molekuláris mintázatoknak”, amelyekről csak úgy ordít, hogy egy kórokozóból származnak. Más szavakkal: ha egy falósejt CpG oligonukleotiddal találkozik, biztos lehet benne, hogy a közelben kórokozók ütötték fel tanyájukat, a harc már folyik, és ideje neki is csatába indulnia.
Márpedig a falósejteknek az a szokásuk, hogy miközben harcra készülnek, nemcsak fegyverzetüket öltik fel, de harsány indulót is fújnak a többieknek, vagyis serkentő citokineket termelnek.
A tumorba juttatott CpG oligonukleotid tehát – TLR9 nevű sejtfelszíni receptoraikon keresztül – mozgósítja a helyben lévő falósejteket, amelyek ennek hatására nagy mennyiségű serkentő citokint bocsátanak ki környezetükbe. E serkentő citokinek eljutnak az ugyanitt veszteglő T-sejtekhez, amelyek ettől fokozzák egyik saját sejtfelszíni receptorfehérjéjük, az OX40 termelését. Az OX40 egyike azoknak a kostimulációs érzékelőknek, amelyekről fentebb mint az aktiválódás egyéb feltételeiről szóltunk: átbillenti az aktiválódási gáton azokat az effektor T-sejteket, amelyek T-sejt-receptorukon keresztül kapcsolódtak ugyan a nekik megfelelő antigénhez, ám végrehajtó potenciáljuk felszabadításához további megerősítésre várnak. Csakhogy az OX40 puszta kihelyezése a sejtfelszínre ehhez nem elegendő, mert a receptort valamilyen módon működésbe kell lendíteni. Pontosan ezt a célt szolgálja a tumorellenes koktél második összetevője, az OX40-ellenes antitest, amely az OX40-hez kapcsolódva azt a benyomást kelti a receptorban, mintha természetes liganduma kapcsolódott volna hozzá, s ezzel megadja a végső lökést a T-sejt teljes harckészültségbe helyezéséhez. Érdekes módon az immunválaszt leszabályozó regulátor T-sejtekre az OX40 serkentése épp ellentétesen, vagyis gátlólag hat, miáltal az effektor T-sejtek még inkább felszabadulnak az elnyomás alól.
A végeredmény: a CpG és az anti-OX40 egészen parányi – néhány mikrogrammnyi, vagyis milliomod grammyi – mennyisége a daganatba fecskendezve felébreszti az addig ott dermedtségbe kényszerített immunsejteket, és olyan teljes körű T-sejtes immunválaszt indukál, amely összevethető egy kórokozó által kiváltott védekező reakcióval. Csakúgy, mint egy vírus behatolása esetén, amikor a vírusfertőzött sejtekkel találkozó ölő T-sejtek klónhadsereget képeznek és a szervezet minden apró zugába elküldik katonáikat vírusvadászatra, a daganatban felocsúdó T-sejtek is klónhadsereget állítanak fel, melyben minden fegyver a daganat antigénjeire van kiélesítve. S hasonlóan ahhoz a fajlagos védettséghez, amelyet egy vírusfertőzés után élethosszig élvezünk, a CpG/anti-OX40 koktél is immunissá tesz ugyanazon daganattípus ismételt támadásával szemben.
Az immunrendszer még mindig kenterbe veri az orvosi technológiát
Az immun-onkoterápiában azért rejlik olyan hatalmas és mindmáig kiaknázatlan potenciál, mert az immunrendszer képességei a legmodernebb orvosi technika lehetőségeit is messze túlszárnyalják.
Az immunrendszer oda is belát, ahová a legkisebb endoszkópok és a legmodernebb képalkotó műszerek sem láthatnak, és oda is elér, ahová a sebész kése sosem érhet. Ha egy érzékeny képalkotó vizsgálattal az egész szervezetet átvilágítjuk, pár milliméternél kisebb daganatkezdeményt aligha észlelhetünk, pedig egy ekkora növekmény már sok millió sejtből áll; az immunrendszer ugyanakkor egyetlen daganatsejtet is képes lefülelni. Még a leggyakorlottabb sebész se lehet sosem biztos abban, hogy egy daganatot maradéktalanul kivágott-e, sőt, néha tudatosan le kell mondania a rákos szövet teljes kimetszéséről, ha azzal létfontosságú szervek épségét kockáztatná. Az immunrendszer számára viszont jószerivel nem létezik hozzáférhetetlen hely, ezért alig akad olyan zug a szervezetben, ahol akár csak egyetlen tumorsejt is a leleplezés esélye nélkül elrejtőzhetne. S míg nincs az a műtét, amely egy áttétekkel teleszórt tüdőből vagy májból minden egyes tumoros gócot el tudna távolítani, az immunrendszernek úgyszólván mindegy, hogy egy, kettő vagy száz egyforma ellenséggel kell megküzdenie. Ha a Levy laboratóriumában kidolgozott módszer az emberekben is alkalmas lesz arra, hogy feloldozza a tumorellenes immunválasz béklyóit, az onkológia olyan segítőtársat kap, amely hatszázmillió évnyi tapasztalattal rendelkezik, és technológiája sok száz évvel a miénk előtt jár.














































.jpg)









