A sejteket felépítő molekulák építőegységei között fontos folyamatok játszódnak le. A folyamatokban bekövetkező hibák, vagy az építőegységek torzulása súlyos betegségekhez vezethet. Ahhoz, hogy ezt a mikroszkopikus világot jobban megértsék, egy új eljárást dolgoztak ki magyar és német kutatók, akik eredményeikről az Angewandte Chemie című szaklapban számoltak be - közölte az ELTE.
Szervezetünkben a fehérjék építőkövei az aminosavak. Az aminosavak sorrendje határozza meg a fehérjék tulajdonságait és azt, hogy milyen folyamatokban játszanak szerepet. Az utóbbi években egyre nagyobb az érdeklődés a rendezetlen fehérjék iránt, melyek nem rendelkeznek stabil szerkezettel, mozgékonyak és szerkezeti sokaságok halmazaként írhatók le - innen ered a megnevezésük is.
A beszámoló szerint a kutatások rávilágítottak arra, hogy a rendezetlen fehérjék, illetve rendezetlen fehérje szakaszok fontos szabályozó szerepet játszanak különböző biokémiai folyamatokban, és több megbetegedés kialakulásához is hozzájárulnak. Így
kapcsolatba hozhatók a Parkinson és Alzheimer-kórral, rákos megbetegedésekkel, valamint a 2-es típusú cukorbetegséggel is.
"Egy rendezetlen fehérje bővelkedik hidrofil oldallánccal és töltéssel rendelkező aminosavakban, illetve gyakori a »szerkezettörő« tulajdonsággal bíró prolin jelenléte is. A prolin különleges felépítésének köszönhetően nehezen vizsgálható, ugyanakkor jelentős biokémiai szabályozási folyamatokban vesz részt, így átfogó jellemzése kiemelt fontossággal bír" - mutattak rá.
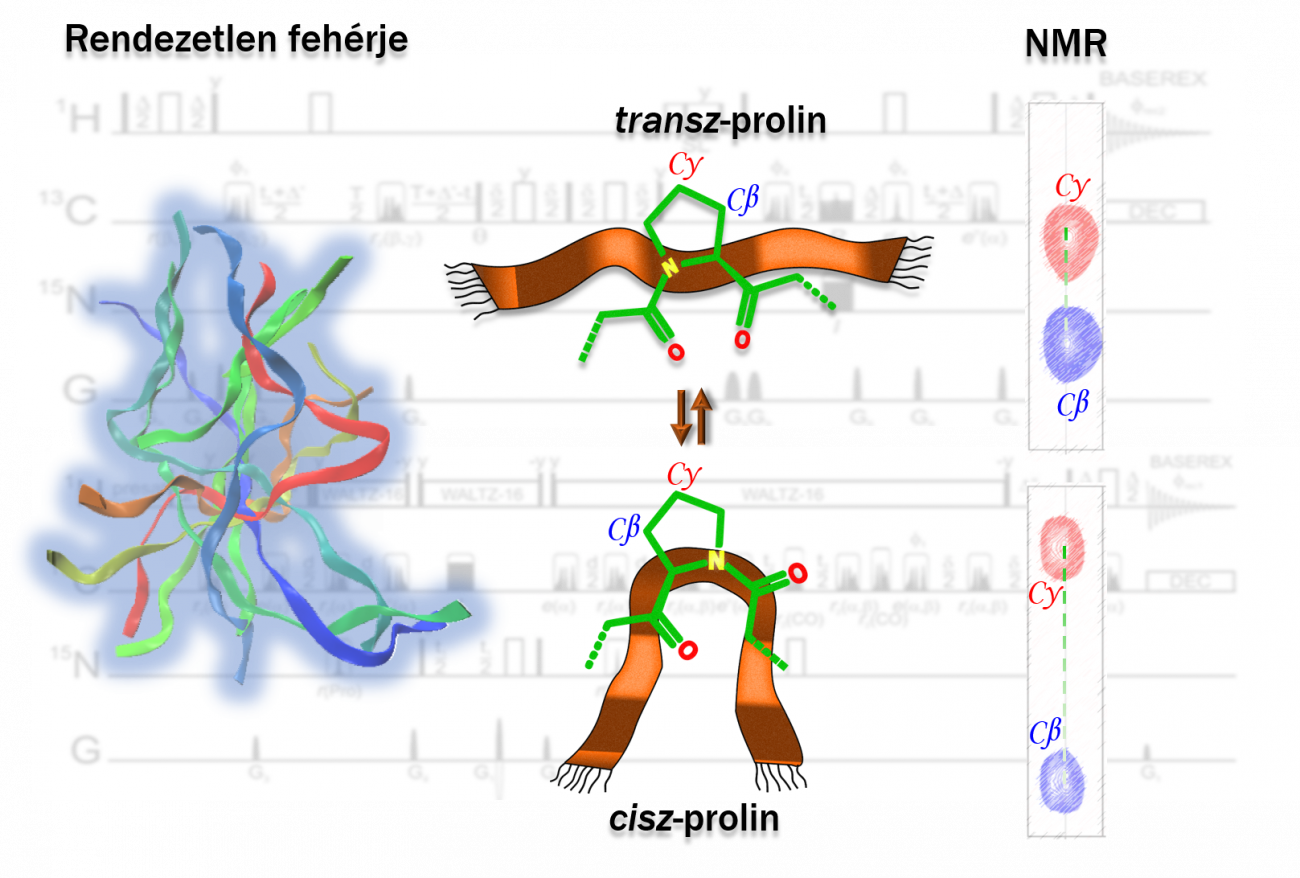
Az ELTE Természettudományi Kar (TTK), a német karlsruhei KIT egyetem és a Bruker cég kutatói közösen olyan, új mágneses magrezonancia méréseken alapuló (NMR: Nuclear Magnetic Resonance) spektroszkópiai módszert fejlesztettek ki, amivel pontosabban, könnyebben és gyorsabban lehet egy rendezetlen fehérje működését feltérképezni.
"Olyan eljárást kellett fejlesztenünk, ami lehetővé teszi aránylag rövid mérési idő alatt kis mennyiségű prolin izomer észlelését, kiváló felbontás mellett. Az új technika előnye, hogy a mérések bármely bioNMR laborban elvégezhetőek, nem kell speciális mérőfejekkel ellátott készülékeken mérni" - hangsúlyozta a közleményben Bodor Andrea, a kutatás vezetője.
A módszertani áttörés lehetővé teszi, hogy eddig feltáratlan, vagy nehezen tanulmányozható biokémiai folyamatokat jellemezni lehessen.
A születendő eredmények rávilágítanak a lejátszódó folyamatok mechanizmusára és nagymértékben hozzájárulnak egyes betegségek kialakulásának megértéséhez - olvasható a közleményben.